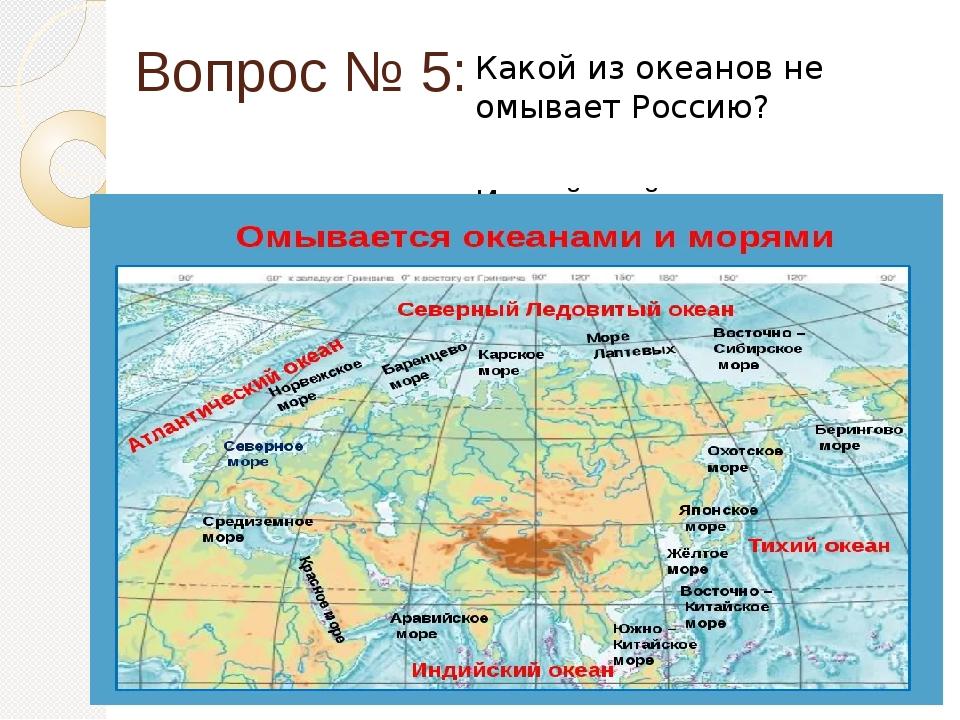
Մետաղական նմուշ մաս 1 - ամենահեշտը
Նախորդ հոդվածն ավարտվեց լիթիումային բջիջների փորձի նախադիտմամբ, որոնք անցյալ տարի ստացել են քիմիայի Նոբելյան մրցանակը։ Երեք դրվագից բաղկացած սերիալը, որը սկսվում է լիթիումի ներկայացմամբ, կլինի հալոգեն շարքի շարունակությունը, որն ավարտվեց դեկտեմբերին։ 17-րդ խմբի տարրերը մոդելային ոչ մետաղներ են, իսկ լիթիումը մետաղականության ստանդարտն է։
Ֆիզիկական հատկություններին ծանոթ ընթերցողներ լիթիումի մետաղներկարող է զարմանալ նման հայտարարությունից. Նյութերը, որոնք սովորաբար հալվում են 100 ° C-ից ոչ ավելի ջերմաստիճանում, բավականաչափ փափուկ են դանակով կտրելու համար և, ի լրումն, արագ արձագանքում են թթվածնի և ջրի հետ, պե՞տք է դրանք լինեն մետաղների ստանդարտ: Իսկ ի՞նչ կարելի է կառուցել դրանցից։
Լիթիումի համաձուլվածքները իսկապես հարմար չեն կառուցվածքային նյութերի համար, բայց դա չի փոխում այն փաստը, որ դրանք լիարժեք մետաղներ են: Անհամապատասխանության պատճառը կենցաղային և գիտական լեզվով այս հասկացության տարբեր ընկալումն է։ Հետևաբար, ամեն մետաղ չէ, որ ամուր և ոչ այրվող նյութ է, օրինակ՝ սնդիկը:
Թեթև արմատ...
Գազային ջրածնից և հելիումից հետո պարբերական համակարգում հայտնվում է առաջին մետաղը՝ լիթիումը։ Ամբողջ ընտանիքն իր անունը ստացել է նրա անունից (ջրածինը, թեև այն նույնպես պատկանում է 1-ին խմբին, մի փոքր անհրաժեշտության դեպքում դրա մեջ էր. պարզապես պետք էր ինչ-որ տեղ տեղադրել այս մյուս տարրը): Վերադառնալով լիթիումին՝ անունը պատահական չէ 0,54 գ/սմ խտություն ունեցող նյութի համար։3դա նույնն է, ինչ սոճու անտառը։
Լիթիումի մի կտոր լողում է ջրի մեջ, բայց ոչ երկար, քանի որ արագ արձագանքում է դրա հետ։ Այս երկու պատճառներով էլ այն պահվում է պինդ պարաֆինում, քանի որ այն հոսում է կերոսինի մակերեսի վրա, որն օգտագործվում է մնացած ալկալային մետաղները թթվածնից և խոնավությունից պաշտպանելու համար: Լիթիումը հալվում է մոտավորապես 180°C ջերմաստիճանում (բոլոր ալկալիական մետաղներից ամենաբարձրը), բայց եռում է գրեթե 1200°-ից բարձր: Դուք հազվադեպ եք տեսնում այդքան մեծ տարբերություն: Բացի այդ, դա արծաթամոխրագույն մետաղ է, որը կարելի է կտրել դանակով, սակայն լայնական հատվածի հատվածը արագ մթնում է (թեև ավելի դանդաղ, քան այս խմբի մյուս տարրերը) (1):
1800 թվականին շվեդական կղզում հայտնաբերվեց նրա անունը կրող հանքանյութը։ ծաղկաթերթբայց միայն տասնյոթ տարի անց հետազոտվեց նրա քիմիական բաղադրությունը: Երիտասարդը գործի է անցել Յոհան Ավգուստ Արֆվեդսոն, 25-ամյա ուսանող հայտնի Բերզելիուսը (որին մենք պարտական ենք, ի թիվս այլ բաների, ներկայումս օգտագործվող տարրերի նշանակումները): Արֆվեդսոնը եզրակացրեց, որ հանքանյութը պատկանում է ալյումինոսիլիկատների խմբին, միացությունների մեծ ընտանիք, որը բաղկացած է ալյումինից, սիլիցիումից և թթվածնից, որին հաջորդում է մետաղը, սովորաբար նատրիումը, կալիումը կամ կալցիումը: Թեև անալիզները ցույց են տվել նատրիումի նման մետաղի առկայություն պետալիտի մեջ, դրա զանգվածը չի համընկնում: Այն մոտավորապես երեք անգամ ավելի քիչ էր, քան պետք է լիներ, եթե նատրիումը իսկապես հանքանյութի մի մասն էր (նատրիումի ատոմային զանգվածը 23 միավոր է, լիթիումը ՝ 7 միավոր):
Բերցելիուսը՝ ժամանակի անվիճելի հեղինակությունը, հայտարարեց, որ հայտնաբերվել է նոր տարր, որը նա անվանել է հունարեն lithos բառից, որը նշանակում է քար (2): Ընդգծվեց, որ չնայած վառված այն նման է արդեն հայտնի նատրիումին և կալիումին, որը մեկուսացված է հանքանյութերից, այլ ոչ թե բուսական և կենդանական նյութերից (սակայն, այն նաև կենդանի օրգանիզմների նյութափոխանակության ուղիներում առկա հետքի տարր է): Արֆվեդսոնը նաև նոր մետաղ է գտել մի շարք այլ օգտակար հանածոների մեջ, ինչը հաստատել է անվանման ճիշտությունը։ Միայն մաքուր մետաղական լիթիումը կարող է մեկուսացվել (դրա քլորիդի էլեկտրոլիզով): Ռոբերտ Բունսեն i Augustus' Mattiessens, 1855 թվականին Առաջինի անունը կապված է երկու այլ լիթիումի հայտնաբերման պատմության հետ։
2. Լիթիումի պատմության մեջ կարևոր գործիչներ. Ձախ՝ նրա հայտնագործողը Յոհան Ավգուստ Արֆվեդսոնը (1792-1841): Աջ՝ Յենս Յակոբ Բերզելիուս (1779–1848):
Որքա՞ն լիթիում կա երկրի վրա: Բավականին շատ՝ շերտի մակերևույթի զանգվածի մոտ 0,0065%-ը, ինչը այն դարձնում է 26-րդն իր տարրերի պարունակությամբ։ Թեև տոկոսն առանձնապես բարձր չի թվում, լիթիում կա գրեթե նույնքան, որքան ազոտը, և ավելին, քան ցինկը և անագը: Իսկ տիեզերքո՞ւմ։ Լիթիումը ձևավորվել է Մեծ պայթյունից անմիջապես հետո ջրածնի, հելիումի, բերիլիումի և բորի հետ միասին և մինչ օրս արտադրվում է աստղերում: Այնուամենայնիվ, այն բավականին հեշտ է արձագանքում պրոտոնների հետ, ուստի տիեզերքում կան միայն լիթիումի հետքեր:
... քրտնաջան աշխատանքի համար
Չնայած իր ֆիլիգրանային զանգվածին՝ լիթիումը չի խուսափում աշխատանքից։ Զանգվածում այս տարրի միացություններից ամենամեծ մասնաբաժինը ունի լիթիումի օքսիդի և կարբոնատի օգտագործումը՝ որպես ջերմակայուն ապակիների և կերամիկայի համար ծածկույթների բաղադրիչներ։ Հաջորդը լիթիումի օգտագործումն է էներգիայի աղբյուրներ ստեղծելու համար։ Սա համեմատաբար նոր ծրագիր է, բայց այսօր լայնորեն առկա է աշխարհում՝ փոքր լիթիումային բջիջներից մինչև ժամացույցների կամ համակարգիչների էլեկտրոնային համակարգերի սնուցում, բջջային հեռախոսների, նոթբուքերի և էլեկտրական գործիքների մարտկոցների միջոցով և վերջացրած էլեկտրական մեքենաների մարտկոցներով, օրինակ՝ էլեկտրական մեքենաներում։ հայտնի Tesla Roadster (3):
3. Վերալիցքավորվող Li-ion մարտկոց: Անցյալ տարի քիմիայի ոլորտում Նոբելյան մրցանակը շնորհվել է դրա կառուցման աշխատանքների համար։
և - մետաղի ցածր քաշի պատճառով նրանք միավոր զանգվածի վրա շատ ավելի շատ էներգիա են կուտակում, քան այլ տարրերի վրա հիմնված կառույցների դեպքում: Լիթիումի ճարպաթթուների աղերը (լիթիումի օճառները, օրինակ՝ լիթիումի ստեարատը) արժեքավոր բաղադրիչ են քսանյութերում, որոնք գործում են ջերմաստիճանի լայն տիրույթում (ներառյալ զրոյից ցածր ջերմաստիճանները): Լիթիումի կարբոնատը ամենահին դեղամիջոցն է, որն այսօր օգտագործվում է հոգեկան խանգարումների բուժման համար՝ կայունացնելով նյարդային համակարգի աշխատանքը:
Լիթիումի մետաղը առաջին անգամ օգտագործվել է որպես ամրության հավելում ալյումինի, կապարի և մագնեզիումի համաձուլվածքների համար։ Լիթիումը հեշտությամբ միանում է ջրածնի հետ՝ առաջացնելով հիդրիդ։ Քանի որ այս միացությունն ազատում է ջրածինը, երբ այն փոխազդում է ջրի հետ, այն կարող է օգտագործվել որպես ջրածնի պահեստ: Վերջին պատերազմի ժամանակ լիթիումի հիդրիդն օգտագործվում էր փրկարար բաճկոնները արագ լցնելու համար։ Լիթիում-6 իզոտոպը, երբ ռմբակոծվում է նեյտրոններով, ստեղծում է փորձել (ջրածին-3), որն անհրաժեշտ է ջերմամիջուկային սինթեզի համար։
Միլիոնավոր աստիճանների ջերմաստիճանի և հսկայական ճնշման ազդեցության տակ տրիտումը միանում է դեյտերիումի (ջրածին-2) հետ՝ ազատելով հսկայական էներգիա։ Մինչ այժմ այդ պրոցեսն իրականացվում էր միայն անվերահսկելի՝ ջերմամիջուկային ռումբի պայթյունով (նեյտրոններ մատակարարող և համապատասխան ռեակցիայի պայմաններ ստեղծելով պայթուցիչը սովորական ատոմային ռումբի պայթյունն էր) (4)։
4. Լիթիումի դեյտերիդի հզորությունը – Castle Bravo ջերմամիջուկային ռումբի պայթյունը Բիկինի Ատոլում 1954թ.
լիթիում ձեռքի տակ
Ի տարբերություն այլ լիթիումի մետաղների, լիթիումի մետաղը իսկապես ձեր մատների տակ է: Ձեր աղբյուրը կլինի լիթիումի մարտկոցը: Մի վերցրեք մարտկոցներ միայն ձեր հեռախոսը կամ նոութբուքը միացնելու համար, քանի որ դրանք ապամոնտաժելը վտանգավոր է (մի մոռացեք օգտագործված սարքավորումները հանձնել հավաքման կետ): Փորձեր անցկացնելու համար անհրաժեշտ է միայն նշված հղումը CR2032. Այն հաճախ օգտագործվում է որոշ տեսակի հաշվիչների և համակարգչային մայր տախտակի չիպերի սնուցման համար:
5. Ձախ կողմում - CR2032 տարրը իր «կտրման» հետագա արդյունքներով. պատյան մետաղական լիթիումի շերտով; ոչ ջրային էլեկտրոլիտով ներծծված տարանջատիչ; պլաստիկ օղակ (մեկուսացում); մանգանի երկօքսիդի շերտ; մարմնի երկրորդ մասը.
6. Լիթիումը այրիչի բոցի մեջ:
Տափակաբերան աքցանով սեղմեք կապը (այն կփլվի) և կառուցվածքի բեկորները շարեք սկուտեղի վրա։ Բջիջը բաղկացած է մետաղական մասերից, որոնք կազմում են պատյան, սև սեղմված շերտ, որը պարունակում է մանգանի երկօքսիդ MnO:2, անջուր օրգանական էլեկտրոլիտով ներծծված ծակոտկեն բաժանարար և մեկուսիչ պլաստիկ օղակ (5): Գործի ավելի փոքր հատվածի վրա (բացասական էլեկտրոդ) լիթիում են քսում, այն կարելի է կտրել դանակով և տեսնել, որ այն մթնում է օդում։ Օգտագործեք երկաթե մետաղալարի ծայրը, որպեսզի վերցնեք փափուկ մետաղ և նմուշը մտցրեք այրիչի բոցի մեջ. այն կվերածվի կարմինի (6): Գույնը բնորոշ է նաև լիթիումի միացություններին։ Նման գույն կնկատեք, եթե այրիչի կրակին ավելացնեք 2-րդ խմբի ստրոնցիումի աղեր:
Տեղադրեք պատյանը մնացած մետաղի հետ մի բաժակ ջրի մեջ: Լիթիումի տարրալուծման ռեակցիան ընթանում է նավի մեջ.
Ստացված լուծույթի մեջ ընկղմված ունիվերսալ թուղթը դառնում է կապույտ, ինչը ապացուցում է, որ լիթիումի հիդրօքսիդը ամուր հիմք է (7): Մի թափեք լուծումը. հաջորդ փորձը կանցկացնեք դրա հետ մեկ րոպեից:
7. Ձախ՝ լիթիումի տարրալուծում ջրում (բջջային մարմնի բեկորը տեսանելի է բաժակի ներքևում): Աջ. Ցուցանիշի թղթի կապույտ գույնը ցույց է տալիս, որ ստացված լիթիումի հիդրօքսիդի լուծույթը ալկալային է:
Պրոտեուս
Հայտնաբերողն արդեն նկատել է, որ լիթիումը նման է 1-ին խմբի մնացած տարրերին: Այնուամենայնիվ, լիթիումն իրեն մի փոքր այլ կերպ է պահում, քան իր մեծ եղբայրները:
Նախկինում ստացված լուծույթը լցնել գոլորշիացման սարքի մեջ և զգուշորեն գոլորշիացնել։ Սառչելուց հետո նստվածքը լցնել հնարավորինս քիչ 5-10% աղաթթվի լուծույթով և նորից գոլորշիացնել ջուրը։ Դուք կստանաք լիթիումի քլորիդ LiCl.
Աղի մի մասը լուծեք քիչ քանակությամբ ջրի մեջ և լուծույթը լցրեք փորձանոթի մեջ։ Ավելացնել նատրիումի կարբոնատի լուծույթ Na2CO3. Անոթում պետք է սպիտակ նստվածք առաջանա, իսկ եթե նման բան չես նկատում, տաքացրու փորձանոթը։ Լիթիումի կարբոնատ Li2CO3 այն փոքր-ինչ լուծելի է ջրում, բացի այդ, ջերմաստիճանի բարձրացման հետ նրա լուծելիությունը նվազում է։ Սա անսովոր դեպք է. միացությունների մեծ մասի լուծելիությունը մեծանում է, երբ լուծույթը տաքացվում է, իսկ 1-ին խմբի տարրերի աղերը, այդ թվում՝ կարբոնատները, խիստ լուծելի են։ Նստվածք է առաջանում նաև, երբ լիթիումի քլորիդի լուծույթը մշակվում է ֆոսֆատի կամ նատրիումի ֆտորիդի լուծույթով։
Ռեակցիայի արդյունքները ցույց են տալիս, որ լիթիումը սովորական լիթիում մետաղ չէ: Նրա հատկությունները որոշ չափով նման են հարեւանների երկրորդ խմբին, հատկապես մագնեզիումին:
Փորձեք նմանատիպ թեստերի հետ մագնեզիումովԱյս տարրի աղի լուծույթին ավելացնել կարբոնատի, ֆոսֆատի կամ ֆտորի ցանկացած լուծվող լուծույթ (առավել հասանելի են քլորիդը կամ սուլֆատը): Ամեն դեպքում, դուք կստանաք սպիտակ ավանդներ: Հիշու՞մ եք, որ ածխածնի երկօքսիդը կրաքարի ջրով հայտնաբերել եք: Այնտեղ նույնպես կարբոնատային տեղումներ են լինում։ Բայց մի կարծեք, որ լիթիումը սխալ տեղում է պարբերական աղյուսակում: Սա միավալենտ տարր է, և խմբի ղեկավարի որոշակի տարանջատումը ընտանիքի այլ անդամներից կանոն է պարբերական աղյուսակում (տես ներդիրը՝ Անկյունագծային զարմիկներ):
Ամսական ավելի շատ լիթիում, չի տարբերվում 1-ին խմբի նորմայից։
Տես նաեւ.